新澳内幕资料医药许可引进的专利肽类长效A型肉毒毒素达希斐®在中国内地获批第二个适应症
新澳内幕资料医药(600196.SH;02196.HK)宣布,获许可产品注射用A型肉毒毒素(中国境内商标:达希斐®、英文商标:DAXXIFY®,项目代号:RT002,以下简称“该产品”)的成人颈部肌张力障碍(Cervical Dystonia,简称CD)适应症注册申请近日已获国家药品监督管理局(“国家药监局”)批准,这是达希斐®
获批的第二个适应症。达希斐®的专利配方含有纯150kd核心神经毒素和专利肽辅料RTP004,不含动物蛋白或其他辅助蛋白。
新澳内幕资料医药控股子公司上海新澳内幕资料医药产业发展有限公司(“新澳内幕资料医药产业”)于2018年12月获美国Revance Therapeutics, Inc.许可于区域内(即中国内地、香港及澳门特别行政区)独家进口、使用、开发及商业化(不包括制造)该产品。该产品为DaxibotulinumtoxinA-lanm,拟用于美容适应症,暂时性改善成人因皱眉肌和/或降眉间肌活动引起的中度至重度眉间纹;以及治疗适应症,治疗成人颈部肌张力障碍。
2024年9月,达希斐®美容适应症获国家药品监督管理局(“国家药监局”)批准,用于暂时性改善成人因皱眉肌和/或降眉间肌活动引起的中度至重度眉间纹,作为20多年来同类产品的首次创新,达希斐®采用其专有的肽交换技术(Peptide Exchange Technology,PXT)开发的含有稳定肽制剂和高度纯化的A型肉毒毒素的新一代神经调节剂,为广大患者提供卓越的疗效。
1
颈部肌张力障碍患者疗程
间隔期内症状复发非常普遍

颈部肌张力障碍(Cervical dystonia,CD)是一种慢性神经系统疾病,是临床最常见的局灶性肌张力障碍疾病之一。其特征是颈部肌肉的自发性不自主收缩,导致头部、颈部和肩部的异常运动或姿势改变1。国内外指南共识均推荐“A型肉毒毒素”作为CD的一线治疗选择2,3。目前全球范围内已有多款肉毒毒素制剂上市,出于多次重复注射引起免疫原性的担心,目前肉毒毒素制剂产品的注射疗程一般建议至少间隔3个月(12周)4,但CD患者疗程间隔期内症状复发较为普遍,复发平均时间约为10.5周,在每个疗程末期满意程度较低,是CD患者的常见问题5。
2
中位疗效持续时间达24周,
达希斐®持久改善患者症状

达希斐®于2023年8月14日获得美国FDA批准,用于治疗颈部肌张力障碍6,其治疗CD的III期临床研究(ASPEN-1)于今年2月发表在《Journal of Neurology》杂志上7。全球III期和中国III期临床研究(ASPEN-CN)的汇总研究以摘要形式在今年运动障碍协会(MDS)年会上发表8。研究结果证实了达希斐®在中度至重度原发性颈部肌张力障碍成人中的疗效和安全性,中位疗效持续时间可达24周,与其在眉间纹的III期临床研究和上肢痉挛的II期研究结果中表现出的“长效”特征一致,中位疗效持续为24~28周9-11。达希斐®作为全球首款专利肽类长效A型肉毒毒素制剂,有望解决CD患者治疗中疗程间期内症状复发普遍这一未满足需求,进一步提高患者生活质量,减少每年的治疗次数。
ASPEN-1是一项国际多中心、随机、双盲、安慰剂对照研究7(clinicaltrials注册号:NCT03608397),共招募患者301人。ASPEN-1-CN在中国进行,研究设计与ASPEN-1相同。ASPEN-1和ASPEN-CN汇总分析共纳入患者357人8,其中含中国III期患者56人,占分析人群的15.7%。汇总分析结果显示,与安慰剂相比,第4周和第6周多伦多西方痉挛性斜颈评分量表(TWSTRS)总分较基线的变化均值(DAXI 125U组为-12.0,DAXI 250U组为-11.9)均有统计学差异(p<0.0001),两种剂量均能显著降低TWSTRS总分,改善患者症状。中位疗效持续时间(定义为从开始治疗到TWSTRS总分改善疗效损失到最小剩余益处(“minimum residual benefit”,即TWSTRS总评分改善的峰值治疗效果损失超过80 %)的时间)(95%CI)分别为:达希斐® 250U:22.0(20.1,24.3)周 ;达希斐® 125U:24.1(20.6,28.9)周(见图1)。安全性方面,大多数治疗中出现的不良事件(TEAE)为轻度或中度。治疗组中吞咽困难发生率4.5-4.7%,肌无力发生率4.5-5.4%,低于既往获批的用于CD治疗的其他A型肉毒毒素产品的关键临床研究数据4,12,13。
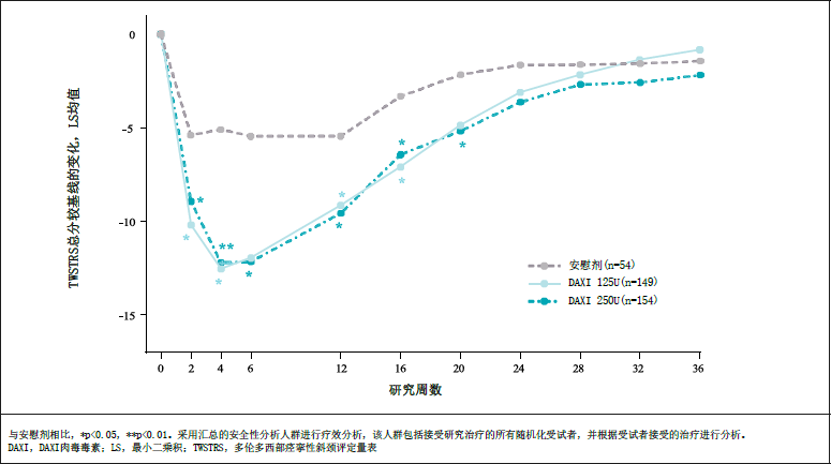
图1. 达希斐®用于治疗CD的TWSTRS总分与基线相比随时间的变化
3
达希斐®未来可期

多位专家对达希斐®获批CD适应证表示热烈祝贺,并对其在我国肉毒毒素疾病治疗领域中的应用前景寄予厚望。
万新华教授
北京协和医院,中国神经科学学会神经毒素分会名誉主任委员,达希斐®中国III期临床研究(ASPEN-1-CN)主要研究单位PI
“
III期临床研究证实了达希斐®的疗效和安全性,尤其持续时间能达到24周是非常不错的结果。事实上,肉毒毒素有着非常广泛的疾病治疗应用前景,如肌张力障碍、自主神经系统疾病、神经病理性疼痛等。期待这款新的A型肉毒毒素的获批,可以造福中国更多患者。
靳令经教授
同济大学附属养志康复医院,中国神经科学学会神经毒素分会主任委员,达希斐®中国III期临床研究(ASPEN-1-CN)参与研究单位PI
达希斐®获批CD适应证为CD患者带来更多治疗选择。达希斐®中位疗效持续时间达24周、持久改善患者症状,对于改善患者长期治疗的依从性,进一步提高患者生活治疗很有意义。同时,其制剂组成“不含动物蛋白,不含辅助蛋白,只含核心神经毒素和专利肽赋形剂RTP004”,为“继发性无应答”的患者带来全新的治疗选择。